Erste Experimente an neuem Röntgenlaser enthüllen unbekannte Struktur von Antibiotika-Killer
DESY-geführtes Konsortium erzielt erste wissenschaftliche Ergebnisse am European XFEL
Eine große internationale Forschergruppe unter DESY-Führung hat die Ergebnisse der ersten wissenschaftlichen Experimente an Europas neuem Röntgenlaser European XFEL veröffentlicht. Die Pionierarbeit zeigt nicht nur, dass die neue Anlage Messungen um mehr als das Zehnfache beschleunigen kann, sie enthüllt auch eine bislang unbekannte Struktur eines Enzyms, das für Antibiotika-Resistenzen eine wichtige Rolle spielt. „Diese Pionierexperimente des ersten Nutzerteams am European XFEL ebnen den Weg für alle nachfolgenden Nutzer der Anlage, die erheblich hiervon profitieren“, betont European-XFEL-Geschäftsführer Robert Feidenhans’l. „Die Ergebnisse zeigen, dass die Anlage noch besser funktioniert als erwartet und im besten Zustand ist, um neue wissenschaftliche Durchbrüche zu liefern.“ Das Forscherteam präsentiert seine Ergebnisse, zu denen auch die erste am European XFEL neu bestimmte Proteinstruktur gehört, im Fachblatt „Nature Communications“.
Download [1.4 MB, 4984 x 3508]
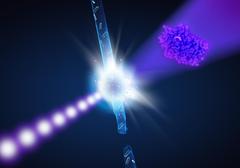
Künstlerische Darstellung des Experiments: Treffen die ultrahellen Röntgenblitze (violett) die Enzymkristalle im Wasserstrahl (blau) lässt sich aus dieser Durchleuchtung die dreidimensionale Form des Enzyms (rechts) rekonstruieren. Bild: DESY/Lucid Berlin„
Da wir als erste an einer völlig neuen Anlage gearbeitet haben, mussten wir zahlreiche Herausforderungen meistern, die zuvor noch niemand angegangen war“, betont DESY-Forscher Anton Barty vom Center for Free-Electron Laser Science (CFEL), der das Team von rund 125 Wissenschaftlerinnen und Wissenschaftlern geleitet hat. „Man kann es mit dem Jungfernflug eines neuartigen Flugzeugs vergleichen: Sämtliche Berechnungen und die gesamte Montage sind getan, alles sagt, es wird funktionieren – aber erst wenn man es versucht, wird man wissen, ob es wirklich fliegt.“
Der 3,4 Kilometer lange European XFEL ist so konzipiert, dass er Röntgenblitze in sehr kurzem Abstand von nur 220 Nanosekunden liefern kann, das sind 0,000 000 220 Sekunden. Die Blitze können beispielsweise dazu benutzt werden, Biomoleküle zu durchleuchten, um ihre dreidimensionale Form zu bestimmen. Die räumliche Struktur von Proteinen und Enzymen verrät Wissenschaftlern etwas über die genaue Funktionsweise dieser Moleküle. Für die Untersuchung werden aus vielen identischen Biomolekülen zunächst kleine Kristalle gezüchtet, die dann mit dem Röntgenlicht durchleuchtet werden. Jeder Kristall erzeugt ein charakteristisches Beugungsbild aus dem Röntgenlicht, das mit einem Detektor aufgezeichnet wird. Lassen sich genug solcher Beugungsbilder von allen Seiten des Kristalls gewinnen, lässt sich daraus seine innere Struktur, und damit auch die seiner Bausteine, der Biomoleküle, in atomarer Auflösung berechnen.

Download [18.0 MB, 5681 x 3787]
Forschungsleiter Dr. Anton Barty (links) von DESY und European-XFEL-Forscher Dr. Richard Bean an der Messstation SPB/SFX. Bild: DESY, Lars Berg
Allerdings lässt sich jeder Kristall mit einem Röntgenlaser nur einmal durchleuchten, weil er durch den intensiven Blitz verdampft (nachdem er das Beugungsbild erzeugt hat). Um die komplette dreidimensionale Struktur des untersuchten Biomoleküls zu bestimmen, muss daher möglichst für jeden Blitz ein neuer Kristall in den Röntgenlaser geschossen werden. Der European XFEL kann mit seiner extrem schnellen Blitzfolge derartige Untersuchungen stark beschleunigen, allerdings hat zuvor noch niemand versucht, mit dieser Geschwindigkeit Proben in atomarer Auflösung zu röntgen. Die schnellste Pulsrate eines Röntgenlasers betrug bisher 120 Blitze pro Sekunde, das bedeutet einen Abstand von 0,008 Sekunden zwischen den Blitzen, also 8 000 000 Nanosekunden.
Die winzigen Kristalle werden üblicherweise in einem Wasserstrahl in den Pfad des Röntgenlasers gesprüht. Auch Wasser verdampft durch den Blitz, und somit muss sich ein intakter Wasserstrahl rechtzeitig vor dem nächsten Blitz wieder ausbilden. „Wir haben die Geschwindigkeit des Wasserstrahls, der die Proben transportiert, auf bis zu 100 Meter pro Sekunde beschleunigt – das entspricht ungefähr dem Geschwindigkeitsrekord in der Formel 1“, erläutert Max Wiedorn vom CFEL, der mit seinem Institutskollegen Dominik Oberthür für diesen Probentransport verantwortlich war. Eine maßgeschneiderte Düse sorgte dabei für einen stabilen Wasserstrahl mit den nötigen Eigenschaften.

Download [5.4 MB, 5616 x 3744]
Der für den European XFEL maßgeschneiderte Adaptive Gain Integrating Pixel Detector (AGIPD) macht die schnellsten Röntgen-Serienbilder der Welt. Bild: DESY
Um die Beugungsbilder in schneller Folge aufzuzeichnen, hatte ein internationales Konsortium unter Leitung von DESY-Wissenschaftler Heinz Graafsma in jahrelanger Arbeit eine der schnellsten Röntgenkameras der Welt entworfen und gebaut, maßgeschneidert für den European XFEL. Anders als bei gewöhnlichen Digitalkameras besitzt beim „Adaptive Gain Integrating Pixeld Detector“ (AGIPD) jedes Pixel 352 eigene Speicherzellen, die dann in einem Durchgang ausgelesen werden. Zudem lässt sich die Empfindlichkeit jedes einzelnen Pixels individuell regeln. So kann der Detektor nicht nur mit der ultraschnellen Pulsrate des European XFEL mithalten, sondern auch einen enormen Empfindlichkeitsbereich abdecken und damit feinste Variationen in den Beugungsmustern darstellen.
„Die Anforderungen des European XFEL sind so einzigartig, dass der Detektor von Grund auf neu entworfen und für diese Aufgabe maßgeschneidert werden musste“, berichtet Graafsma, der die Detektorgruppe im DESY-Forschungsbereich Photon Science leitet und Professor an der Mittelschwedischen Universität in Sundsvall ist. „Das war nur dank der umfassenden Expertise und fruchtbaren Kooperation des gesamten großen Teams möglich.“

Download [7.1 MB, 5516 x 3677]
Röntgenlaser-Pionier Prof. Henry Chapman, Leitender Wissenschaftler bei DESY, blickt in die Probenkammer der Messstation am European XFEL. Bild: DESY, Lars Berg
Die Forscher testeten die neue Anlage zunächst mit einer sehr gut untersuchten Substanz, dem Enzym Lysozym aus Hühnereiweiß. Tatsächlich passt die am European XFEL bestimmte Struktur, die feine Details von bis zu 0,18 Nanometern (millionstel Millimetern) zeigt, perfekt zu der bereits mit hoher Detailgenauigkeit bekannten Struktur des Enzyms. „Das ist eine exzellente Bestätigung der Leistungsfähigkeit der Anlage“, unterstreicht Röntgenlaser-Pionier Henry Chapman, Leitender Wissenschaftler bei DESY und Professor an der Universität Hamburg. „Wir sind begeistert von der Geschwindigkeit der Analyse: Experimente, die sonst Stunden in Anspruch genommen haben, lassen sich jetzt in ein paar Minuten durchführen, wie wir gezeigt haben. Und der von uns verwendete Aufbau lässt sich sogar noch weiter optimieren, wodurch die Messgeschwindigkeit noch zusätzlich steigt. Der European XFEL bietet glänzende Aussichten für die Erkundung des Nanokosmos.“
Die beeindruckende Leistung des Röntgenlasers ist insbesondere auch ein Erfolg des DESY-Beschleunigerteams, das den Bau des weltweit längsten supraleitenden Linearbeschleunigers geleitet hat, der den European XFEL antreibt und auch vom DESY-Beschleunigerkontrollraum aus gesteuert wird.
Download [1.7 MB, 2539 x 2657]
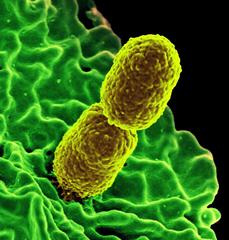
Antibiotika-resistente Bakterien der Art Klebsiella pneumoniae (gelb) unter dem Elektronenmikroskop. Bild: National Institute of Allergy and Infectious Diseases (NIAID)
Als zweite Probe wählten die Forscher ein bakterielles Enzym, das eine wichtige Rolle bei Antibiotika-Resistenzen spielt. Das Molekül mit der Bezeichnung CTX-M-14-β-Laktamase isolierten die Wissenschaftler aus dem Bakterium Klebsiella pneumoniae. Von diesem Bakterium kursieren zum Teil mehrfach resistente Stämme in Krankenhäusern und stellen dort ein gravierendes Problem dar. Vor zwei Jahren wurde in den USA sogar ein Stamm identifiziert, der nach Angaben der US-Seuchenschutzbehörde CDC gegen alle 26 gewöhnlich verfügbaren Antibiotika resistent war.
Das Enzym CTX-M-14-β-Laktamase kommt in allen Stämmen des Bakteriums vor. Es funktioniert wie eine Art molekulare Schere und zerschneidet die sogenannten Laktam-Ringe der Penizillin-Antibiotika, wodurch diese wirkungslos werden. Um dies zu vermeiden, werden Antibiotika häufig mit der Substanz Avibactam zusammen verabreicht. Avibactam legt sich gewissermaßen zwischen die Scherenblätter des Enzyms und blockiert so die Schneidefunktion. Durch Mutationen kann sich jedoch die Form der molekularen Schere ändern. „Manche Krankenhausstämme von Klebsiella pneumoniae können bereits speziell entwickelte Antibiotika der dritten Generation spalten“, berichtet Ko-Autor Christian Betzel, ebenfalls Professor an der Universität Hamburg. „Wenn wir verstehen, wie das genau geschieht, könnte das eventuell dabei helfen, Antibiotika zu entwerfen, die dieses Problem umgehen.“
Download [1.0 MB, 1388 x 1071]
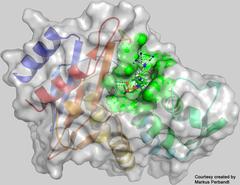
Die in den Messungen bestimmte dreidimensionale Struktur des Enzyms CTX-M-14-β-Laktamase mit dem daran gebundenen Inhibitor Avibactam am aktiven Zentrum (grün). Bild: Universität Hamburg, Markus Perbandt
Die Forscher durchleuchteten einen Komplex der CTX-M-14-β-Laktamase des nicht-resistenten, gewöhnlichen „Wildtyps“ des Bakteriums mit dem angekoppelten Inhibitor Avibactam an seinem aktiven Zentrum. „Die Ergebnisse zeigen mit 0,17 Nanometern Genauigkeit, wie sich das Avibactam genau in eine tiefe Furche auf der Enzymoberfläche schmiegt, der das aktive Zentrum darstellt“, erläutert Ko-Autor Markus Perbandt von der Universität Hamburg. „Diesen spezifischen Komplex hatte zuvor niemand je gesehen, allerdings war die Struktur der beiden separaten Komponenten bereits bekannt.“
Die Messungen zeigen, dass sich Strukturinformationen von hoher Qualität mit dem European XFEL gewinnen lassen. Die Forscher sehen dies als einen ersten Schritt zur Aufzeichnung von Serien-Schnappschüssen von biochemischen Reaktionsabläufen zwischen Enzymen und ihren Substraten. Zusammen mit den Ko-Autoren Martin Aepfelbacher und Holger Rohde, Professoren am Hamburger Universitätsklinikum Eppendorf (UKE), plant das Team, den Röntgenlaser im nächsten Schritt als eine Art Filmkamera einzusetzen, um aus solchen Serienbildern einen Film der molekularen Dynamik von Enzym und Inhibitor zu erstellen. „Solche Filme würden uns entscheidende Einblicke in den biochemischen Prozess geben, die uns eines Tages helfen könnten, bessere Inhibitoren zu entwerfen und damit Antibiotikaresistenzen zu reduzieren“, sagt Betzel.
Download [740KB, 3508 x 1414]
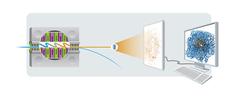
Prinzip der Röntgenkristallographie: Ein Elektronenstrahl (blau) erzeugt in der magnetischen Slalombahn eines sogenannten Undulators (links) einen Röntgenblitz (orange). Trifft dieser Blitz auf einen Proteinkristall, entsteht ein charakteristisches Beugungsbild auf dem Detektor, aus dem sich die räumliche Struktur des betreffenden Proteins am Computer berechnen lässt. Bild: DESY, Cyprian Lothringer
Filme von chemischen und biochemischen Reaktionen sind nur ein Beispiel aus einem breiten Spektrum neuer wissenschaftlicher Experimente, die durch den European XFEL möglich werden. Ein Schlüsselfaktor ist dabei die Geschwindigkeit, mit der sich Daten sammeln lassen. „Das eröffnet ganz neue Wege in der Strukturforschung“, unterstreicht Ko-Autor Adrian Mancuso, Leiter der Messstation SPB/SFX (Single Particles, Clusters and Biomolecules & Serial Femtosecond Crystallography) am European XFEL, wo die Experimente stattgefunden haben. „Der Unterschied bei der hier gezeigten Geschwindigkeit, mit der Entdeckungen am European XFEL möglich sind, ist so drastisch wie der Unterschied der Reisezeit über den Atlantik zwischen einem Schiff und einem Flugzeug. Die Auswirkungen können immens sein.“
Diese erste wissenschaftliche Messzeit am European XFEL hat zwei Wochen nach der Eröffnung der Anlage im September 2017 stattgefunden und war für alle Wissenschaftlerinnen und Wissenschaftler auf diesem Feld geöffnet, die teilnehmen, beitragen, lernen und Erfahrungen an der neuen Anlage sammeln konnten. „Der Erfolg dieser Strategie der ‚offenen Forschung‘ zeigt sich unter anderem an der schnellen Veröffentlichung von Ergebnissen späterer Messkampagnen an der SPB/SFX-Instrument durch teilnehmende Gruppen“, erläutert Chapman. „Darüber hinaus hat die konzertierte Kombination von Können aus der gesamten Forschungsgemeinde erfolgreich zuvor ungelöste Aufgaben beim Management und der Visualisierung von Daten gemeistert, was entscheidend für alle Röntgenkristallographie-Serienuntersuchungen am European XFEL ist.“
DESYs Forschungsdirektor für Photon Science, Edgar Weckert, beglückwünschte alle Forscherinnen und Forscher der ersten Messzeit zu ihrer Pionierleistung: „Diese großen Erfolge zeigen das volle Potenzial des supraleitenden Röntgenlasers für Hochdurchsatzanalysen, die die Forschung auf diesem Gebiet grundlegend verändern können.“
Originalarbeit
„Megahertz serial crystallography“; Max O. Wiedorn, Dominik Oberthür, Richard Bean, Robin Schubert, Nadine Werner et al.; „Nature Communications“, 2018; DOI: 10.1038/s41467-018-06156-7
Weitere Informationen
Die serielle Femtosekunden-Röntgenkristallographie („serial femtosecond X-ray crystallography“, SFX) ist eine überaus leistungsfähige Methode zur Bestimmung der atomaren Struktur verschiedener Proben, typischerweise Biomoleküle wie Proteine. Das Verfahren baut auf der klassischen Kristallographie auf, die vor mehr als einem Jahrhundert entwickelt wurde. In der Kristallographie werden Röntgenstrahlen auf einen Kristall gerichtet. Der Kristall beugt die Röntgenstrahlen auf charakteristische Weise und bildet ein Beugungsmuster auf dem Detektor. Wenn von allen Seiten des Kristalls genügend Beugungsmuster aufgezeichnet werden, kann seine innere Struktur aus den kombinierten Mustern berechnet werden, wodurch die Form seiner Bausteine, also der Moleküle, sichtbar wird.
Die meisten Biomoleküle sind jedoch sehr empfindlich, werden leicht durch Röntgenstrahlen beschädigt und bilden nur schwer Kristalle. Oftmals lassen sich nur sehr kleine Kristalle züchten. Die kurzen, aber extrem hellen Blitze von Röntgenlasern wie dem European XFEL überwinden dabei gleich zwei Probleme: Sie sind hell genug, um selbst aus kleinsten Kristallen brauchbare Beugungsmuster zu erzeugen, und sie sind so kurz, dass sie von den Strahlenschäden nicht beeinflusst werden. Ein typischer Röntgenlaserblitz dauert nur wenige Femtosekunden (billiardstel Sekunden) und hat den Kristall bereits verlassen, bevor dieser verdampft. Diese Methode heißt „Diffraction before Destruction“ (etwa „Beugung vor Zerstörung“). Da aber jeder Kristall in einem einzigen Blitz verdampft wird, muss bei jedem Blitz ein neuer Kristall geröntgt werden. Deshalb sprühen die Wissenschaftler Tausende von zufällig orientierten Proteinkristallen in den Pfad des Röntgenlasers und zeichnen Serien von Beugungsmustern auf, bis sie genügend Daten gesammelt haben, um die Struktur des Proteins atomgenau zu berechnen.
Um diese Daten am European XFEL effizient aufzuzeichnen, muss der Detektor die schnellsten Röntgen-Serienbilder der Welt aufnehmen: Der European XFEL liefert Röntgenblitze in zehn Pulsfolgen („pulse trains“) pro Sekunde. In jeder Folge liegen die Blitze nur 220 Nanosekunden (milliardstel Sekunden) auseinander. Keine zuvor existierende Röntgenkamera konnte mit dieser hohen Geschwindigkeit Bilder aufnehmen. Die Entwickler des „Adaptive Gain Integrating Pixel Detector“ (AGIPD) mussten einen Trick anwenden: Im Gegensatz zu herkömmlichen Digitalkameras ist jedes Pixel dieser Megapixel-Röntgenkamera mit eigenen 352 Speicherzellen ausgestattet, die mit einer Rate von fast 5 Megahertz (MHz) beschrieben werden können und damit der Pulsfrequenz des Röntgenlasers entsprechen. In diesen Speicherzellen werden die Bilddaten zwischengelagert und gemeinsam zehnmal pro Sekunde ausgelesen. Auf diese Weise kann der AGIPD 3520 Bilder pro Sekunde aufnehmen. Dabei erzeugt er einen Datenstrom, der zwei vollen DVDs pro Sekunde entspricht. Außerdem passt jedes Pixel seine Empfindlichkeit dynamisch an das einfallende Röntgenlicht an. Diese adaptive Verstärkung erweitert den Empfindlichkeitsbereich des Detektors erheblich. Im gleichen Bild kann es Pixel mit nur einem Photon und solche mit Tausenden von Photonen geben. Dieser große Dynamikbereich ist mit herkömmlichen Digitalkameras nicht möglich. Beim European XFEL ist zurzeit ein AGIPD installiert und in Betrieb, ein zweiter wird in den nächsten Monaten installiert. Das Projekt wird von European XFEL, DESY und dem Schweizer Paul-Scherrer-Institut finanziert, das Entwicklerkonsortium umfasst Mitglieder des Paul Scherrer Instituts, der Universität Hamburg, der Universität Bonn und von DESY.
Der zu einem großen Teil von Deutschland finanzierte European XFEL ist eine neue internationale Forschungseinrichtung im Raum Hamburg, die für Forschungsgruppen aus aller Welt offen ist. Er ist der größte Röntgenlaser der Welt und erzeugt ultrakurze und extrem helle Röntgenblitze. Der European XFEL wird von einem rund zwei Kilometer langen supraleitenden Linearbeschleuniger angetrieben, der von einem von DESY geführten Konsortium gebaut wurde und von DESY betrieben wird. Er beginnt auf dem DESY-Gelände in Hamburg und beschleunigt Elektronen in engen Bündeln auf fast Lichtgeschwindigkeit. In sogenannten Undulatoren werden die Elektronenpakete dann durch einen magnetischen Slalomkurs getrieben. In jeder Kurve strahlen die Teilchen Röntgenstrahlung ab, die sich zu einem laserähnlichen Puls addiert. Der European XFEL ist so konzipiert, dass er 27 000 solcher Röntgenpulse pro Sekunde erzeugen kann. XFEL steht für X-ray free-electron laser, also Freie-Elektronen-Röntgenlaser, da die frei fliegenden Elektronen laserartige Röntgenblitze erzeugen. Diese Blitze können in der Experimentierhalle im schleswig-holsteinischen Schenefeld auf insgesamt sechs Messstationen verteilt werden, die als wissenschaftliche Instrumente bezeichnet werden und sich jeweils auf verschiedene Forschungsbereiche spezialisiert haben wie die Kartierung der atomaren Details von Viren, die Entschlüsselung der molekularen Zusammensetzung von Zellen, das dreidimensionale „Fotografieren“ der Nanowelt, das „Filmen“ chemischer Reaktionen und das Erforschen von Prozessen, wie sie tief in den Planeten stattfinden. Zwei Instrumente sind derzeit in Betrieb, die anderen sollen in naher Zukunft in Betrieb gehen. Der Betrieb der Anlage ist European XFEL übertragen, einer gemeinnützigen Gesellschaft, die eng mit ihrem Hauptgesellschafter DESY und anderen Organisationen weltweit zusammenarbeitet. Derzeit haben 12 Länder die European-XFEL-Konvention unterzeichnet: Dänemark, Deutschland, Frankreich, Großbritannien, Italien, Polen, Russland, Schweden, Schweiz, Slowakei, Spanien und Ungarn.
Das Center for Free-Electron Laser Science (CFEL) ist eine gemeinsame Einrichtung der Universität Hamburg, der Max-Planck-Gesellschaft und von DESY.
DESY zählt zu den weltweit führenden Beschleunigerzentren und erforscht die Struktur und Funktion von Materie – vom Wechselspiel kleinster Elementarteilchen, dem Verhalten neuartiger Nanowerkstoffe und lebenswichtiger Biomoleküle bis hin zu den großen Rätseln des Universums. Die Teilchenbeschleuniger und die Nachweisinstrumente, die DESY an seinen Standorten in Hamburg und Zeuthen entwickelt und baut, sind einzigartige Werkzeuge für die Forschung. DESY ist ein Forschungszentrum der Helmholtz-Gemeinschaft und wird zu 90 Prozent vom Bundesministerium für Bildung und Forschung und zu 10 Prozent von den Ländern Hamburg und Brandenburg finanziert.

